Una domanda ai nosstri esperti di elettrochimica sul funzionamento delle batterie.
Com’è possibile che all’interno di una batteria, elettroni e ioni non seguano lo stesso percorso?
Questa domanda è stata recentemente posta in occasione di un webinar riservato agli installatori di Storelio.
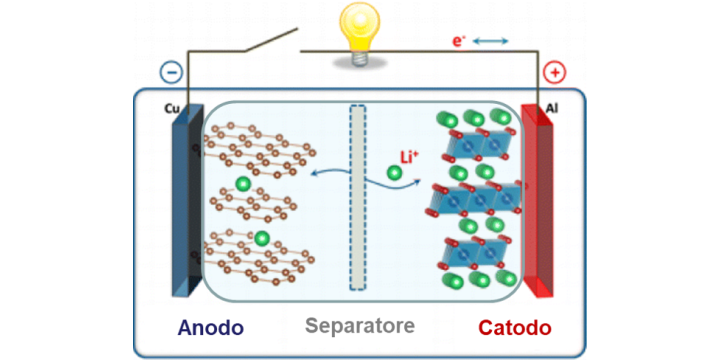
Le batterie sono dei dispositivi che trasformano l’energia chimica in energia elettrica e viceversa. Le batterie sono costituite da due elettrodi (poli + e -) separati da un materiale ionico conducente ma elettricamente isolante (qui separatore + elettrolita).
Quando un’apparecchiatura è collegata ai poli della batteria, si verifica una reazione di ossidazione nell’anodo che rilascia elettroni e ioni di litio.
Gli elettroni con carica negativa vengono attratti dal catodo e passano attraverso il circuito elettrico alimentando l’apparecchiatura mentre gli ioni si spostano dall’anodo al catodo all’interno della batteria.
Infine, elettroni e ioni si uniscono al catodo dove avviene una reazione di riduzione.
In sintesi, all’interno della batteria, i trasferimenti di energia sono solo chimici (ioni che passano tra i 2 elettrodi), mentre gli elettroni (l’elettricità) passano tra i poli della batteria attraverso l’apparecchiatura alimentata.